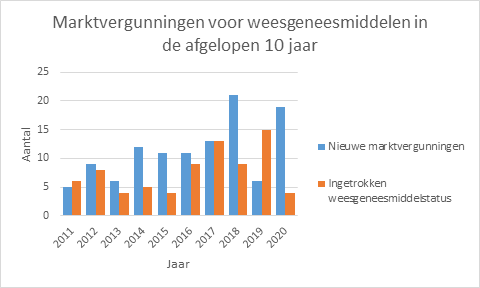
Om de ontwikkeling van weesgeneesmiddelen te stimuleren, zijn speciale regelingen van toepassing. In 2020 hebben maar liefst 19 nieuwe weesgeneesmiddelen een marktvergunning gekregen in de Europese Unie (Figuur 1). Dit is fors meer dan gemiddeld de afgelopen 10 jaar het geval was. Alleen in 2018 was dit aantal net iets hoger, met 21 nieuwe middelen. In de afgelopen 10 jaar zijn in totaal 113 nieuwe weesgeneesmiddelen op de markt gekomen.
Zes van de nieuwe 20 weesgeneesmiddelen hebben een voorwaardelijke marktvergunning gekregen. Dat wil zeggen dat de vergunning is verleend op basis van minder uitgebreide klinische gegevens dan normaal vereist is. Een voorwaardelijke markvergunning is maar tijdelijk (één jaar) geldig, waarbij de fabrikant binnen vastgestelde termijnen de klinische gegevens moet aanvullen. Als die beschikbaar zijn, kan de voorwaardelijke marktvergunning omgezet worden in een normale marktvergunning.
Eén weesgeneesmiddel heeft een ‘uitzonderlijke’ marktvergunning gekregen. Dit type vergunning wordt verleend aan geneesmiddelen waarvan de aanvrager geen volledige gegevens kan verstrekken over de werkzaamheid en veiligheid. Dit vanwege het feit dat de te behandelen aandoening zeldzaam is of omdat het verzamelen van volledige informatie niet mogelijk of onethisch is.
De indicaties voor de nieuwe weesgeneesmiddelen zijn uiteenlopend. Onder andere voor cystische fibrose en metachromatische leukodystrofie zijn medicijnen goedgekeurd. Vier middelen zijn oncologische weesgeneesmiddelen. Het volledige overzicht van medicijnen goedgekeurd in 2020 staat hieronder in Tabel 1. De data komt van de website van de EMA.
In 2020 is van vier weesgeneesmiddelen de weesgeneesmiddelstatus ingetrokken of verlopen (Tabel 2). Dit is een stuk minder dan het voorgaande jaar, toen ging het om 15. De weesgeneesmiddelstatus kan worden ingetrokken op verzoek van de vergunninghouder of omdat de periode van 10 jaar (eventueel met extra jaren vanwege het voldoen aan verplichtingen) verlopen is. De meeste weesgeneesmiddelen blijven wel op de Europese markt beschikbaar maar dan zonder weesgeneesmiddelstatus.
Kolbam is een product dat van de Europese markt is verdwenen. De actieve werkzame stof in Kolbam -cholzuur- is al jaren slecht beschikbaar. Onze promovenda Yasmin Polak doet onderzoek naar het gebruik van cholzuur voor zeldzame ziekten.
Tabel 1: Nieuwe geregistreerde medicijnen voor zeldzame ziekten 2020 in Europa
(1) Toegelaten met voorwaardelijke marktvergunning(2) Toegelaten onder uitzonderlijke omstandigheden
| Naam medicijn | Indicatie(s) | Werkzame stof |
|---|---|---|
| Daurismo | Acute myeloïde leukemie | Glasdegib maleaat |
| Fintepla | myoclonus epilepsie | Fenfluramine hydrochloride |
| Libmeldy | Metachromatische leukodystrofie (MLD) | Gentherapie met genetisch gemodificeerde autologe CD34+ hematopoëtische stam- en voorlopercellen (HSPC) |
| Isturisa | Cushing-syndroom | Osilodrostat-fosfaat |
| Polivy (1) | B-cellymfoom | polatuzumab vedotine |
| Blenrep (1) | Multipel myeloom (Ziekte van Kahler) | belantamab mafodotin |
| Kaftrio | Cystische fibrose (CF, taaislijmziekte) | ivacaftor, tezacaftor, elexacaftor |
| Obiltoxaximab SFL (2) | Antrax (miltvuur) | Obiltoxaximab |
| Oxlumo | Primaire hyperoxalurie (PH) | Lumasiran natrium |
| Adakveo (1) | Sikkelcelziekte | Crizanlizumab |
| Arikayce liposomal | Luchtweginfecties | Amikacine sulfaat |
| Zolgensma (1) | Spinale musculaire atrofie (SMA) | onasemnogene abeparvovec |
| Ayvakyt | Gastro-intestinale stromale tumor (GIST) | avapritinib |
| Hepcludex | chronische hepatitis D | Bulevirtide acetaat |
| Idefirix (1) | Preventie van orgaanafstoting na een niertransplantatie | Imlifidase |
| Pretomanid FGK (1) | Multiresistente tuberculose | Pretomanide |
| Reblozyl | Myelodysplastisch syndroom (beenmergziekte) Betathalassemie (erfelijke bloedziekte) | Luspatercept |
| Trepulmix | Pulmonale hypertensie | Treprostinil natrium |
| Givlaari | Hepatische porfyrie | Givosiran natrium |
Tabel 2: Ingetrokken of verlopen weesgeneesmiddelenstatus in 2020 in Europa
| Naam medicijn | Indicatie(s) | Werkzame stof | Reden intrekken status weesgeneesmiddel | Nog verkrijgbaar in Europa |
|---|---|---|---|---|
| HELIXATE NEXGEN | Hemofilie A (aangeboren factor VIII-tekort) | Octocog alfa | Op verzoek van de vergunninghouder | Nee |
| Kolbam | Galzoutsynthesedefecten | Cholzuur | Op verzoek van de vergunninghouder | Nee |
| OFEV | Idiopathische longfibrose | Nintedanib | Op verzoek van vergunninghouder | Ja |
| Tepadina | Hematopoëtische stamceltransplantatie | Thiotepa | Einde 10 jarige periode van marktexclusiviteit | Ja |


